국내에는 제반 검사 환경과 관련 내용의 논의 부족으로 뿌리내리지 못했지만
미국에서는 정동장애를 생화학 관점에서 풀어낸 내용들이 다수 있습니다.
이중 가장 높은 빈도를 갖고 있는 상위 원인을 소개한 내용입니다. 그중 메틸레이션 장애가 있습니다.
그 밖에도
아연 결핍
구리 과잉
엽산 결핍 혹은 과잉
피롤 장애
중금속 과잉
EPA, DHA 및/혹 AA 결핍 등이 눈에 띕니다.
이 모든 부분들이 신경전달물질 합성이나 조절에 다 영향을 미치기 때문에
관련 부분에 대한 검사가 가능하다면 상위 원인 교정에 대한 영양의학적 치료를 시행해볼 수가 있습니다.
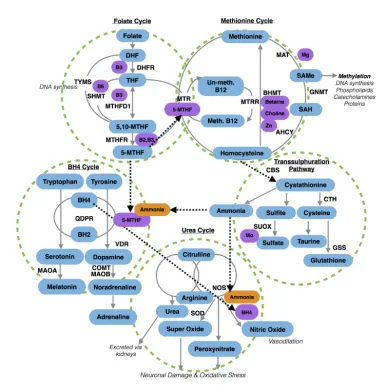
정동장애에서 메틸레이션이 중요한 이유는
1차적으로는 메틸레이션 효소들이 세로토닌, 도파민 등의 신경전달물질 합성 및 분해에 작용하기 때문입니다.
호모시스테인의 리메틸화로 만들어진 SAMe는 도파민을 비롯한 카테콜라민을 분해하는 COMT 효소에 꼭 필요한 기질이 되고, MTHFR 효소의 전환으로 만들어진 5-MTHF(활성형엽산)는 BH4-BH2 산화 환원에 관여하여 세로토닌, 도파민의 신경전달물질 합성을 촉진하게 됩니다.
하지만, 더 중요한 부분은 시냅스 공간의 신경세포에 발현되는 막단백질이 더 중요합니다. 뒤에서 설명드리겠습니다.
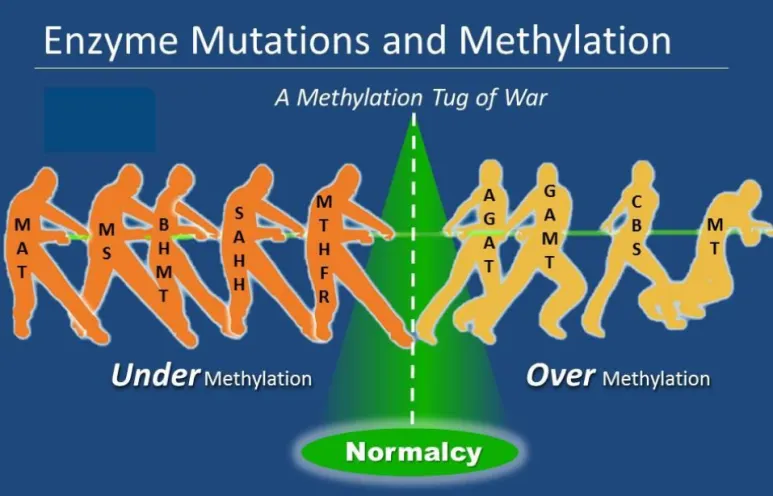
메틸레이션 장애와 연관된 정동장애는 크게 두 부류가 있습니다.
오버메틸레이션(과메틸화)
언더메틸레이션(저메틸화)
과메틸화와 저메틸화의 차이는 SAM이 넘쳐나냐, 부족하냐의 의미입니다.
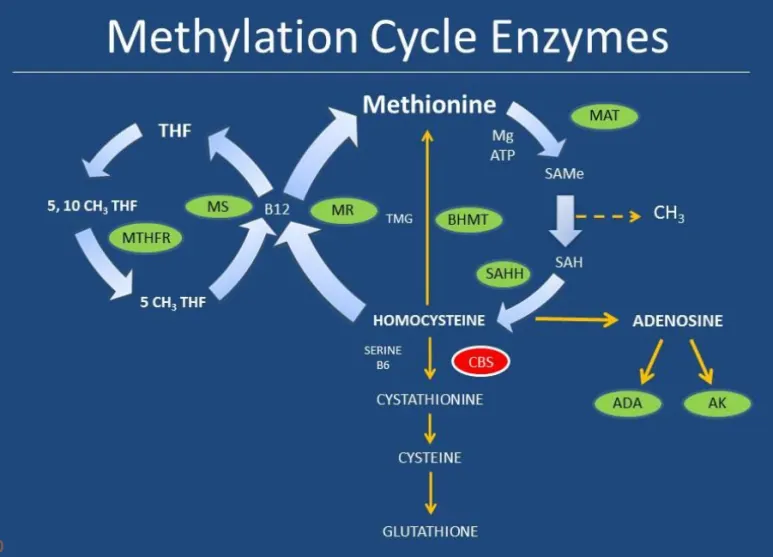
SAM은 메티오닌이 마그네슘+ATP의 도움을 받아 전환이 됩니다.
SAM은 메틸화효소가 있는 곳이라면 메틸기를 전달해주는 기질로 참여합니다.
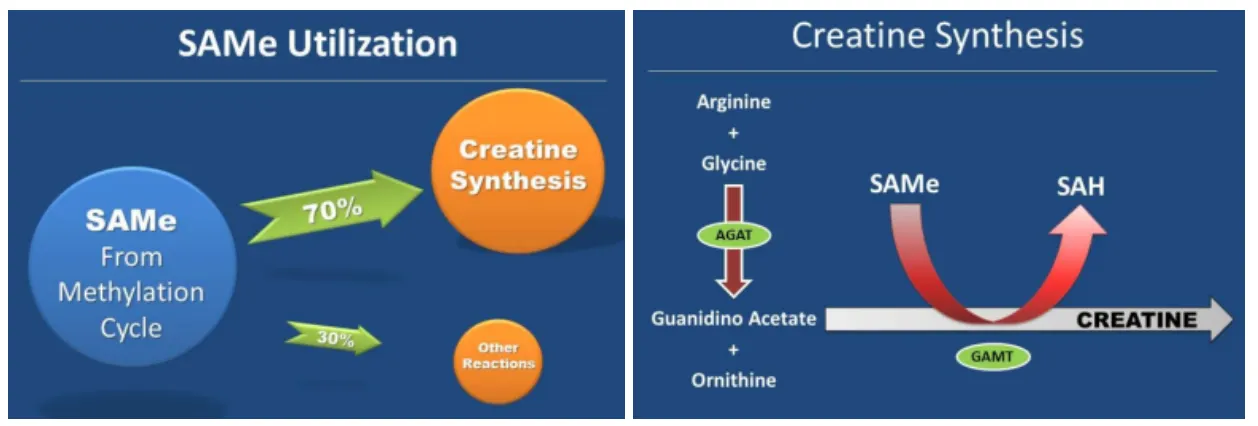
SAM의 70%는 크레아틴합성에 관여를 하고, 나머지 30%는 여러 메틸화효소에 활용이 된다고 하네요.
크레아틴 합성할 때 AGAT, GAMT가 관여를 하는데 이 두 효소에 변이가 있으면 크레아틴 합성이 저하가 되기 때문에 SAM이 넘쳐날 수가 있겠죠. 이게 과메틸화의 원인 중 하나입니다.
저메틸화와 관련된 효소들은 SAM을 만들 때 필요한 효소들인 경우가 대부분이고,
과메틸화와 관련된 효소들은 아까 크레아틴 합성 연관 효소들, 그리고 CBS(호모시스테인을 황전환경로로 유입시키는 첫 효소) 등과 연관이 있습니다.
그 외에도 저메틸화 장애의 원인으로는 히스타민 과잉이 있습니다.
흔히 히스타민 불내증(Histamine intolerance), 히스타민 증후군(Histamine syndrome) 등은 인체에서 처리하기 힘든 정도의 히스타민이 있는 상태를 말하는데 히스타민의 대사 중에 SAM이 많이 소진되기 때문에 그렇습니다.
단백질 결핍이나 흡수장애는 주로 메티오닌과 연관된 것으로 동물성 어육류 섭취를 소홀히 한 채식 위주의 식습관을 한 분들이나 위산 저하 등으로 인해 단백질 소화가 잘 안되는 분들의 문제인 경우가 대부분입니다.
과메틸화 장애의 원인은 앞서 말했듯 크레아틴 합성과 연관된 효소의 변이라든지, 크레아틴 합성에 필요한 아르기닌, 글리신 등이 부족한 경우가 있습니다. 그런데 애초에 육식을 적절히 하게 되면 크레아틴 자체가 어육류에서 바로 공급되고, 전구아미노산들도 충분히 공급되기 때문에 이럴 일이 거의 없습니다.
또한 메틸화효소의 변이가 있어도 SAM이 잘 활용되지 않는다는 것이므로 넘쳐나는 환경이 됩니다.
각각의 분류 상에서 더 자주 동반되는 질환들이 다릅니다.
자폐스펙트럼장애(ASD)는 저메틸화 장애와 높은 연관이 있고, 불안장애나 ADHD는 과메틸화 장애와 더 연관이 있습니다.
시냅스 공간에 세로토닌, 도파민 같은 신경전달물질이 얼마나 오래 작용을 하는지는 이러한 신경전달물질을 마치 진공청소기처럼 빨아들이는 막단백질의 발현이 중요합니다.
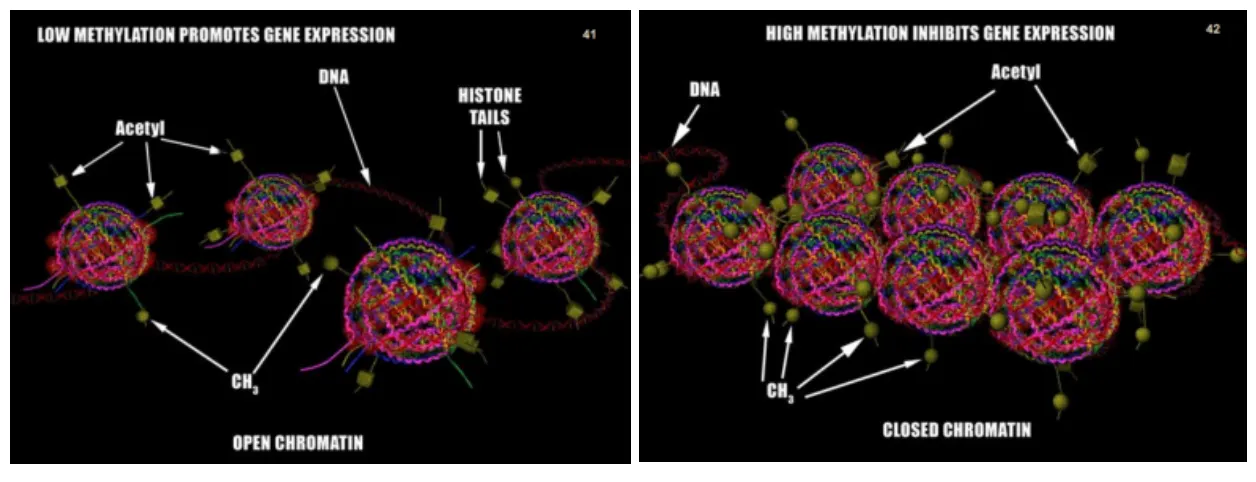
이러한 유전자들의 발현에서 중요한게 DNA 메틸화, 히스톤 아세틸레이션과 연관된 조절입니다. 경우에 따라 다르겠지만 대체로 과메틸 되면 히스톤은 응축되고 DNA 발현은 억제가 되는게 보통입니다. 그래서 막단백질 발현이 줄어들고, 시냅스 공간에 신경전달물질이 좀더 오래 있을 수 있는 환경이 됩니다.
또한 아세틸레이션은 히스톤 pH를 낮춰서 DNA 풀림이 좀더 쉬워지고, 메틸레이션은 반대로 히스톤 pH가 증가되어 응축되는 경향이 있습니다. 아세틸화 시키는 효소의 기질은 아세틸-코엔자임A가 담당하고, 메틸화시키는 효소의 기질은 SAM이 담당을 합니다.
이와 연관해 효소들은 아세틸화 효소, 탈아세틸화 효소, 메틸화효소, 탈메틸화효소 가 있는데
아세틸화 효소와 탈메틸화효소는 발현 촉진
탈아세틸화효소와 메틸화효소는 발현 억제 등으로
같은 작용의 방향성을 나타냅니다.
예를 들어 B3가 탈아세틸화효소의 억제 효능이 있는데 그로써 SERT, DAT 등의 막단백질 발현이 증가 되므로 시냅스 내 공간의 세로토닌과 도파민이 빠르게 회수가 될 수가 있습니다.
대략적으로 저메틸화와 과메틸화 장애의 정동장애 특징이 저렇게 대별되는지 이제 대략적으로 아실 수 있겠죠?
그러나, 치료는 그렇게 간단하지가 않아요.
저메틸화 장애, 과메틸화 장애를 치료하는 전략이 복잡해지는 이유는 메틸화 장애를 교정하는 여러 영양성분들이 신경전달물질 활성에 각기 다른 방향으로 영향을 미칠 수 있기 때문입니다.
대표적인 게 바로 이 엽산입니다. 폴산, 폴린산, 메틸엽산 등 구조를 막론하고 엽산류들은 메틸레이션을 회복하는데 중요한 영양성분입니다.
하지만 엽산은 SERT 라는 운반단백질 발현을 증가시키기도 하는데, 그 결과로 시냅스에서 세로토닌이 빠르게 회수가 됩니다. 대부분의 저메틸화 장애에서는 낮은 세로토닌 활성과 연관이 있는데 엽산에 더 취약해지는 것입니다.
엽산은 세로토닌 외에도 도파민, 노르에피네프린에도 비슷한 기전으로 활성 효율을 떨어뜨립니다.
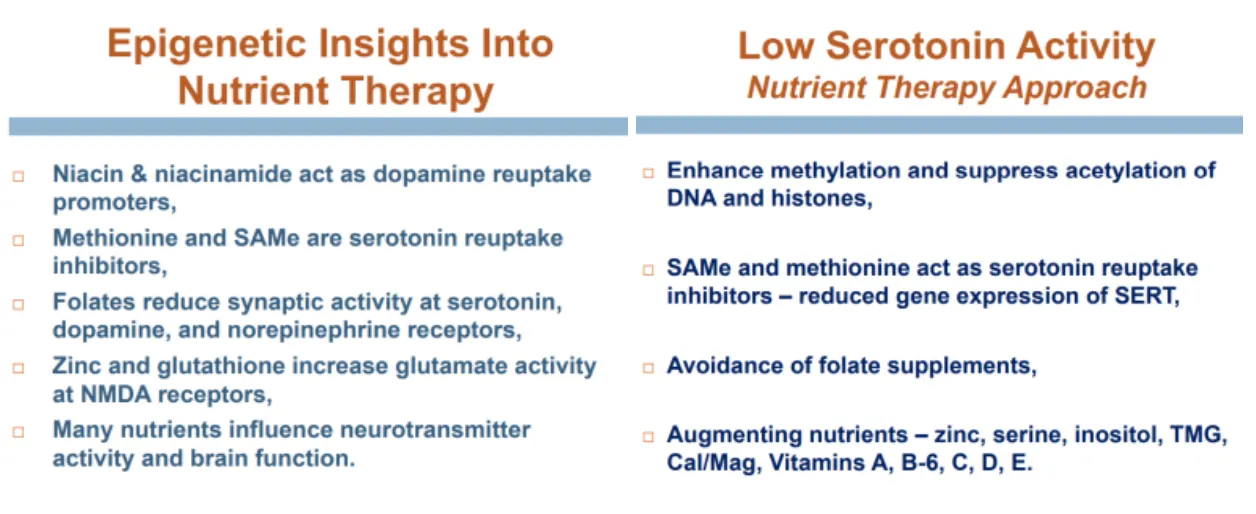
니아신, 니아신아마이드(B3)는 도파민 재흡수 촉진 (시냅스 내 도파민 농도 감소)
메티오닌, SAMe는 세로토닌 재흡수 억제 (시냅스 내 세로토닌 농도 증가)
아연, 글루타치온은 글루탐산 활성 증가(NMDA 수용체)
그래서 낮은 세로토닌 양상의 정동증상들을 교정하기 위해서는 엽산류는 피하고, 메티오닌, SAMe, 아연 같은 게 도움이 된다고 하는 거에요. 그래도 어렵긴 마찬가지입니다.